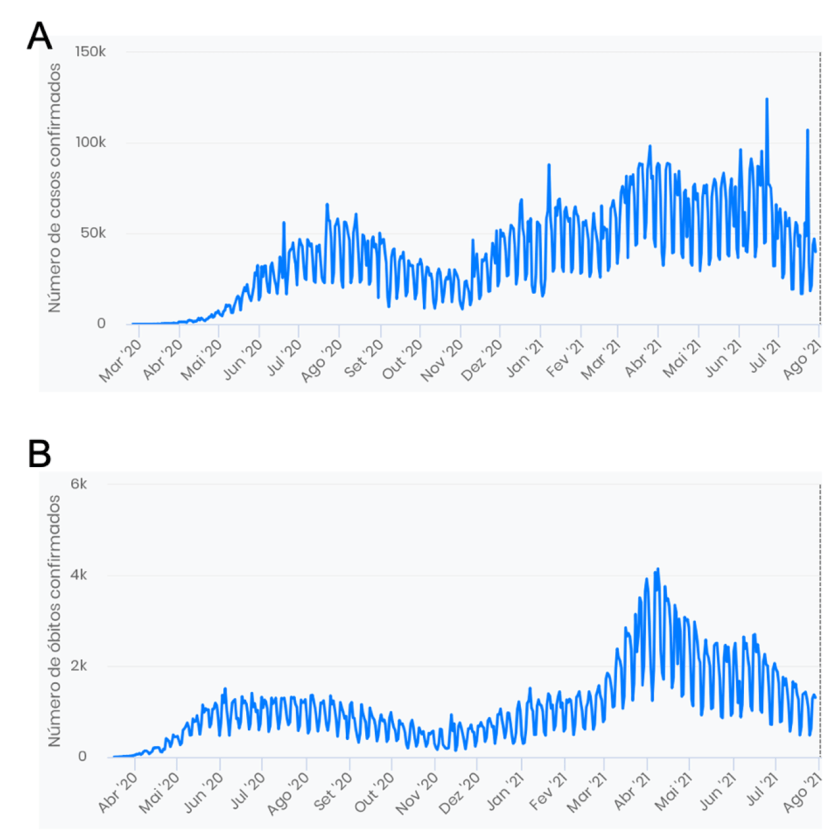
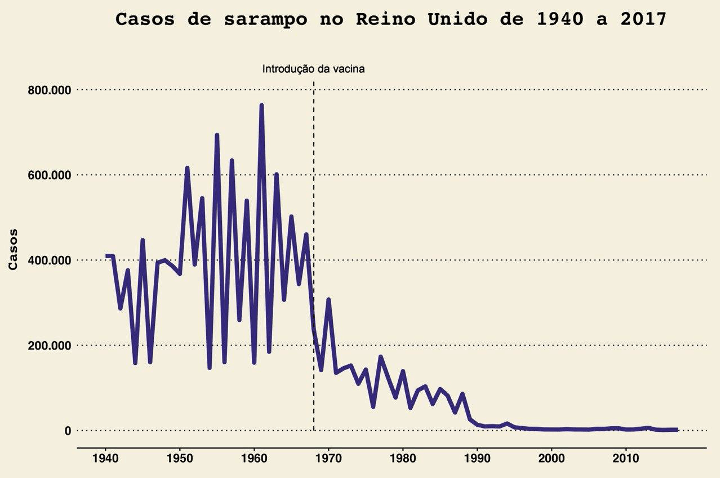
Ainda em 2020 evidências mostraram de modo consistente que a hidroxicloroquina não é um tratamento efetivo para a COVID-19. Isso não diminuiu o debate em torno dessa droga, que tem gerado muito burburinho. Um dos resultados foi a interrupção prematura de estudos sobre o uso dessa droga na prevenção da COVID-19. Quais lições devemos tirar desse episódio?

Há alguns dias, comecei a receber de diversos amigos e colegas, que sabem de meu interesse sobre os debates em torno dos estudos sobre um possível papel da (hidroxi)cloroquina no tratamento e na prevenção da COVID-19, uma revisão sistemática e meta-análise recente sobre o uso profilático desse medicamento, ou seja, na prevenção dessa doença. A razão de meu interesse reside no fato de que o caso da (hidroxi)cloroquina é um prato cheio para uma estratégia de ensino que uso em meus cursos na UFBA, combinando questões sociocientíficas e aprendizagem baseada em problemas. Isso porque muitos estudos que testaram essa droga foram marcados por inúmeros problemas metodológicos e é possível detectar a interferência de interesses e valores em sua condução, sem falar da ampla controvérsia sociopolítica.
Questões sociocientíficas são problemas ou situações controversas e complexas vivenciadas por sociedades contemporâneas nas quais o conhecimento científico tem papel fundamental nas origens, na compreensão e/ou na busca de soluções. Além disso, uma questão sociocientífica é passível de transposição para a sala de aula, como uma ferramenta de ensino e aprendizagem, favorecendo a discussão de relações entre ciência, tecnologia, sociedade e ambiente, bem como de aspectos éticos dos problemas sociais e da pesquisa científica. A caracterização do que é uma questão sociocientífica já sugere, de imediato, por que o caso da (hidroxi)cloroquina desperta interesse para uso em tal abordagem pedagógica.
O que mais me despertou a atenção, contudo, foi o relato de que o artigo que me foi enviado estava circulando em determinados grupos como referência fundamental a favor de um papel da (hidroxi)cloroquina na prevenção da COVID-19, inflamando ânimos já muito excitados na controvérsia fortemente carregada de conotações políticas em torno desse medicamento.
O problema é que o artigo em questão não apresenta de fato evidências a favor de um papel da hidroxicloroquina na prevenção da COVID-19. O que ele conclui é que as evidências disponíveis ainda são insuficientes para excluir um papel profilático desse medicamento no caso dessa doença. A diferença é muito importante: falta de evidências suficientes é algo muito diferente de evidência a favor de uma tese que se pretende defender. Além disso, o artigo já se inicia com uma conclusão que contradiz expectativas muito defendidas, com um ardor tão grande que gera muito calor e pouca luz: “A hidroxicloroquina não é um tratamento efetivo para COVID-19 estabelecida”. Esta, sim, é uma conclusão já muito bem estabelecida a partir das evidências disponíveis. Ora, tudo isso deveria ser bastante claro. Afinal, estas são conclusões que saltam aos olhos quando lemos o artigo.
Como, então, as pessoas não viram isso? A primeira razão que me vem à cabeça é muito óbvia, provavelmente correta: elas nem leram o artigo e convenceram-se das supostas conclusões disseminadas por determinado grupo apenas por memes e mensagens nas redes sociais. Quanto a esta razão, a indicação é simples e direta: informem-se em fontes de qualidade, busquem – se possível – inclusive verificar as fontes originais, certifiquem-se de que não estão sendo enganados por fake news, antes de sair defendendo conclusões visceralmente.
Contudo, o que gostaria de examinar aqui é uma razão mais interessante, ainda que mais hipotética no atual estado de coisas. Suponhamos que uma pessoa se dispõe a ler o artigo original, ou, ao menos, um relato fidedigno dos seus achados. Será que há condições em que ela chegaria a conclusões diferentes daquelas que saltam aos olhos no artigo, por exemplo, de que ele apresenta evidências favoráveis ao uso da hidroxicloroquina na prevenção da COVID-19? Uma condição que poderia resultar nessa situação é o chamado “raciocínio motivado”, um fenômeno psicológico no qual as pessoas elaboram e avaliam argumentos e/ou examinam dados e evidências de forma enviesada, buscando alguma interpretação que se acomode a e/ou favoreça alguma crença preexistente. Outra condição, contudo, consiste na dificuldade de as pessoas entenderem como o trabalho científico é realizado, como os argumentos científicos são construídos, que fatores intervêm na construção e defesa de tais argumentos, entre outros elementos.
Antes de seguirmos com esse argumento, devemos, no entanto, examinar o artigo que me foi enviado, para considerar o que é ali relatado.
Uma revisão sistemática e meta-análise de estudos sobre o uso da hidroxicloroquina para prevenção da COVID-19
A publicação que estamos examinando relata os resultados de uma meta-análise de ensaios clínicos randomizados e controlados (randomized controlled trials, RCTs) que investigaram a efetividade da hidroxicloroquina na prevenção da COVID-19. Nessa meta-análise, foram incluídos 11 RCTs, sete que investigaram o uso da hidroxicloroquina como meio de evitar contrair a doença antes de exposição conhecida a um indivíduo infectado (profilaxia pré-exposição), e quatro que investigaram o uso desse medicamento após tal exposição (profilaxia pós-exposição). Todos os sete ensaios clínicos voltados para profilaxia pré-exposição eram testes que usaram placebo (ou seja, uma substância ou tratamento inerte, que não apresenta interação com o organismo) como controle e método duplo-cego (nos quais nem pesquisadores nem participantes sabem, durante o teste, quais tratamentos foram atribuídos a cada participante, se placebo ou medicamento). Todos eles foram realizados com trabalhadores da área da saúde que estavam sujeitos a exposição a COVID-19 em seu ambiente de trabalho, mas não apresentavam exposição conhecida a pacientes infectados. Os quatro ensaios clínicos voltados para profilaxia pós-exposição foram realizados com pessoas assintomáticas que haviam entrado em contato com casos confirmados de COVID-19. Estes ensaios têm, contudo, uma fragilidade importante: o tempo entre a exposição a contatos infectados e o início do tratamento foi tão longo que eles podem confundir-se com testes de tratamento precoce da doença com hidroxicloroquina. Assim, os resultados destes últimos ensaios devem ser considerados com maior cautela.
Os critérios de inclusão na meta-análise possibilitaram eleger apenas estudos capazes de produzir evidências de maior qualidade, na medida em que foram admitidos apenas testes controlados e randomizados, com indivíduos cuja infecção pelo coronavírus SARS-CoV-2 havia sido confirmada por PCR (com poucas exceções que, quando excluídas da análise, não afetaram de modo relevante os resultados), e que haviam sido publicados em periódicos arbitrados ou estavam disponíveis como preprints (ou seja, antes de sua publicação em periódico).
Dois autores do estudo avaliaram independentemente os riscos de vieses nos ensaios clínicos. Isso é importante para controlar, na meta-análise, o grau de interferência nos resultados dos ensaios devido a fragilidades no desenho metodológico. Esta avaliação identificou ensaios clínicos com fontes moderadas de viés ou interferência nos resultados, em virtude de dados incompletos sobre a infecção dos participantes e a exclusão de participantes do estudo após terem sido atribuídos ao grupo que recebeu hidroxicloroquina como medida preventiva ou ao grupo controle.
É importante estar atento aos resultados obtidos na meta-análise. Como escrevem os autores, “o benefício da hidroxicloroquina como profilaxia para a COVID-19 não pode ser descartado com base na evidência disponível de ensaios randomizados”. Portanto, a conclusão é de que as evidências disponíveis ainda são insuficientes para excluir um papel profilático da hidroxicloroquina, o que é algo inteiramente distinto de oferecer evidências a favor de um papel dessa droga na prevenção da COVID-19. A razão pela qual as evidências são insuficientes reside na quantidade pequena de ensaios clínicos que puderam ser completados. A principal preocupação dos autores é de que os ensaios randomizados e controlados disponíveis produziram achados que não são estatisticamente significantes, mas isso não deve ser interpretado no sentido de que eles teriam produzido evidências convincentes da falta de efetividade do medicamento na prevenção da COVID-19, mas apenas de que esses estudos não produziram evidências suficientes para uma decisão consistente acerca da hipótese. Em contraste com o uso da hidroxicloroquina no tratamento da COVID-19, cuja ineficácia foi estabelecida de modo convincente ainda no segundo semestre de 2020, como os autores do próprio artigo afirmam já em sua primeira frase, ainda há bastante incerteza sobre os benefícios dessa droga na prevenção ou profilaxia da doença.
Esta incerteza se mostra claramente nos resultados obtidos na meta-análise feita pelos autores. Embora os ensaios clínicos voltados para profilaxia pré-exposição resultem, quando analisados conjuntamente, numa estimativa de risco cerca de 28% menor de contrair COVID-19 no grupo de participantes que recebeu hidroxicloroquina, qualquer efeito entre 5% e cerca de 45% de redução no risco é altamente compatível com os dados colhidos nesses ensaios. Quanto aos ensaios voltados para profilaxia pós-exposição, tanto uma redução substancial quanto um aumento moderado no risco de contrair COVID-19 uma vez administrada hidroxicloroquina se mostrou altamente compatível com os dados obtidos. Não há dúvida, então, de que as evidências disponibilizadas pelos ensaios incluídos na meta-análise são insuficientes para qualquer conclusão mais segura sobre os benefícios, a ausência de benefícios ou os riscos de usar hidroxicloroquina na prevenção da COVID-19. Ou seja, há mais incerteza do que segurança nas conclusões que podemos obter quanto ao uso dessa droga na profilaxia da doença, como a ampla variação nas estimativas de risco obtidas mostra.
A situação poderia ser diferente se os 30 ensaios clínicos planejados no começo da pandemia para investigar uso profilático de hidroxicloroquina tivessem sido realizados, em vez dos 11 somente que foram reunidos na meta-análise. A maioria desses ensaios não foi completada, contudo, porque as comunidades médica e científica chegaram à conclusão de que esse medicamento não tinha efetividade na prevenção da COVID-19 e de que testes adicionais não seriam necessários após os achados de apenas dois desses ensaios terem sido publicados. Essa conclusão prematura envolveu uma confusão entre ausência de efeito e ausência de significância estatística: concluiu-se que a hidroxicloroquina não tinha efeito profilático na COVID-19 quando a conclusão correta era de que as evidências obtidas nos ensaios clínicos disponíveis possibilitavam estimativas de efeito do medicamento na prevenção da doença que eram demasiadamente imprecisas. Os resultados desses ensaios apoiavam, assim, a necessidade de mais testes de um possível papel profilático do medicamento, e não a tese de que não era mais preciso realizar estudos a este respeito.
A emergência de um consenso sobre a ineficácia da hidroxicloroquina na prevenção da COVID-19 foi considerada surpreendente pelos autores da meta-análise, porque os dois ensaios nos quais este consenso se baseou encontraram um risco menor de contrair a doença entre as pessoas às quais foi administrada hidroxicloroquina. Contudo, como as amostras dos dois estudos eram pequenas, os resultados não foram suficientes para excluir seja o benefício seja o prejuízo de tomar essa droga como medida profilática. Mas por que será que houve este salto para uma conclusão negativa sobre o uso da hidroxicloroquina como prevenção da doença na ausência de evidência suficiente? Não há dúvida de que todo o barulho em torno do emprego dessa droga no tratamento da COVID-19, motivada pelo uso político dos achados de ensaios clínicos que produziram evidência frágil e insuficiente a favor de seu papel terapêutico, foi decisivo para que se saltasse a tal conclusão com evidência muito menor do que aquela que estabeleceu, convincentemente, a falta de efetividade da droga como medida terapêutica. Assim, esse uso político causou prejuízos, ao impedir a geração de evidências suficientes e estimativas precisas acerca do uso da hidroxicloroquina na gestão da pandemia antes de vacinas estarem disponíveis. Isso ocorreu porque a convicção sobre a falta de efetividade da hidroxicloroquina na prevenção da doença diminuiu substancialmente a velocidade de recrutamento de pessoas para os ensaios clínicos ainda em andamento que visavam testar esse uso da droga.
Os autores da revisão sistemática e meta-análise que estamos discutindo estavam realizando um ensaio clínico para testar o uso da hidroxicloroquina na prevenção da COVID-19 e, como ocorreu em outros estudos, enfrentaram sérias dificuldades para recrutar pacientes para participar do estudo. Na extrema politização do debate em torno do uso dessa droga no tratamento da doença, foi ignorado o fato de que, ainda em 2020, já havia evidência suficiente para mostrar que a hidroxicloroquina não tem papel na terapia da doença, e isso levou, paradoxalmente, a dificuldades em estudos que buscavam testar outro papel para a droga na gestão da pandemia. Estas são águas passadas, uma vez que a disponibilidade de vacinas eficazes para a COVID-19 reduz a necessidade de medidas farmacológicas de prevenção. Contudo, é importante aprender com esse evento, de modo a aprimorar a geração e interpretação de evidências antes que enfrentemos a próxima emergência de saúde pública, climática e/ou ambiental.
Quais seriam as lições?
Quais as lições a ser derivadas desse episódio? Mais alguma lenha na fogueira dos conflitos e discursos sobre (hidroxi)cloroquina nas redes sociais? Esta parece ser a lição que muitos têm derivado. Mas certamente não é a lição correta, porque reforça a fonte do problema analisado no artigo, que mostra como a politização extrema dos debates em torno da (hidroxi)cloroquina tem sido prejudicial. Em vez de deslocar os juízos sobre o uso de um medicamento para controvérsias sobre opiniões nas redes sociais, teria sido mais apropriado aguardar as conclusões de estudos feitos por comunidades científicas relevantes (como as de pesquisadores biomédicos, epidemiologistas, virologistas etc.), desde que tivessem a qualidade esperada nas práticas científicas aceitas por essas comunidades. Certamente não é o caminho para alcançar julgamentos de melhor qualidade usar o artigo que estamos discutindo para alimentar ainda mais debates mal-informados sobre a (hidroxi)cloroquina, mal-informados tanto no sentido do entendimento do conhecimento científico em si mesmo quanto em termos do modo como este é produzido e validado. Um caminho mais preferível é utilizar esse artigo para entender o impacto negativo das controvérsias em torno do medicamento, que tiveram e seguem tendo lugar especialmente nas redes sociais; o papel fortemente político dessas controvérsias (nas quais não é a busca de conclusões seguras, mas sobretudo a construção de discursos que favoreçam a posição politica de certos grupos que tem sido almejada); e a necessidade de aguardar conclusões mais seguras da comunidade científica sobre o que está sendo pesquisado, antes de criar um acalorado debate que gera mais fogo do que luz.
Como argumenta Bruno Latour, em Políticas da natureza, se não temos boas razões para questionar uma conclusão científica, ela deve ser tomada como um ponto de partida para deliberação (notem: não como um ponto final, porque há mais envolvido na deliberação social do que apenas resultados consolidados pela pesquisa científica). Mas, antes disso, é preciso que haja espaço para que tais boas razões sejam alcançadas. Um debate que busca usar resultados científicos ainda não-consolidados para defender posições em embates sociopolíticos cria, por assim dizer, um curto circuito no processo que poderia levar-nos a ter segurança sobre as conclusões científicas, antes de nos metermos a deliberar. Deliberamos, então, sobre bases insuficientes, no que tange ao conhecimento científico disponível, e isso pode levar-nos a cometer grandes equívocos. Os processos naturais não querem saber, contudo, de nossas confusas e acaloradas controvérsias sobre terrenos pantanosos: eles seguem seu curso… E, em seu curso, podem muito bem aumentar nossas incertezas. Necessitamos entender melhor o conhecimento científico e o modo como ele é produzido, bem como a maneira como argumentos científicos são construídos. Como temos defendido desde os primeiros dias de Darwinianas, é urgente que a educação científica e a comunicação pública da ciência se tornem mais capazes de oferecer aos cidadãos melhores ferramentas para compreender como se dão a construção e a validação dos conhecimentos científicos, de como achados da ciência são mobilizados na argumentação, e de como relações entre ciência, tecnologia, sociedade e ambiente intervêm na elaboração e defesa de argumentos que se utilizam de achados científicos.
Charbel N. El-Hani
(Instituto de Biologia/UFBA)
PARA SABER MAIS
García-Albéniz, X., del Amo, J., Polo, R., Morales-Asencio, J. M. & Hernán, M. A. (no prelo). Systematic review and meta-analysis of randomized trials of hydroxychloroquine for the prevention of COVID-19. European Journal of Epidemiology.
Latour, B. (2019). Políticas da natureza. São Paulo: Editora UNESP.