Uma das coisas mais fascinantes, para mim, é pensar que dentro da maioria das nossas células, precisamente dentro do núcleo das nossas células diploides, possuímos aproximadamente 2 metros de DNA. Se considerarmos que o corpo humano possui uma média de 50 trilhões de células, cada um(a) de nós carrega diariamente algo em torno de 100 trilhões de metros de DNA, o equivalente a 300 vezes a distância entre a Terra e o Sol, ou a 2,5 milhões de voltas ao redor do globo! Ainda mais interessante é pensar que, em mamíferos, o tamanho do núcleo varia entre 11 e 22µm (um µm é um milionésimo do metro). Como é possível colocarmos tanto DNA dentro de estruturas tão pequenas como o núcleo celular?
A principal estratégia que evoluiu em nossas células para compactar os 2 metros de DNA dentro do núcleo é enrolá-lo em proteínas, e as principais proteínas utilizadas por células nucleadas, tais como as nossas, são as histonas. Pares de histonas H2A, H2B, H3 e H4 se unem para formar o cerne da estrutura primária de compactação do nosso DNA, o nucleossoma (Figura 1). O DNA dá aproximadamente duas voltas em torno desse conjunto de histonas, e cada núcleo possui centenas de milhares de nucleossomas. Essa é apenas a primeira etapa de compactação do DNA dentro do núcleo celular. Veja aqui mais detalhes a respeito de outras estratégias que evoluíram em nossas células para compactar o DNA.

Hoje conhecemos diversos mecanismos de herança epigenética, dentre os quais a modificação das histonas é um dos principais. Nas últimas décadas, começamos a entender o papel desses mecanismos na saúde e na doença. Por exemplo, hoje sabemos que a desregulação epigenética é uma característica comum em vários tipos de câncer, e a possibilidade de modificar os padrões de herança epigenética abre novas oportunidades de tratamento. Sabemos também que alterações epigenéticas estão ligadas ao envelhecimento, a doenças neurodegenerativas e a diabetes, dentre outras doenças.
Um aspecto bastante curioso dos mecanismos de herança epigenética é que eles sofrem influência dos hábitos de vida do organismo. Ou seja, a epigenética provê uma ligação entre os estímulos ambientais aos quais estamos expostos no nosso dia-a-dia e alterações nos padrões de expressão gênica. Um exemplo interessante dessa ligação é a relação entre dieta e longevidade. Hoje acreditamos que a epigenética pode explicar a relação entre o que comemos e o quanto vivemos. Ainda mais curioso é saber que essas alterações epigenéticas podem ser herdadas, mesmo após a remoção do estímulo inicial. Por exemplo, estudos em camundongos sugerem que o condicionamento ao medo, aprendido pelos pais, é herdado na geração seguinte, e a herança desse comportamento aprendido é mediada por modificações nas histonas.
Conhecemos hoje um número significativo de modificações químicas das histonas que influenciam os padrões de expressão gênica, dentre as quais as principais ainda são a metilação e a acetilação. Mas essa semana diversos pesquisadores revelaram uma nova classe de modificações: a serotonilação de histonas, ou seja, a ligação direta entre a serotonina e as histonas. A serotonina é uma molécula fundamental para o funcionamento do sistema nervoso e participa de diversos processos como inibição de comportamentos agressivos, regulação do sono e do apetite. Por muito tempo, a ideia de que a desregulação dos níveis de serotonina estava diretamente ligada a transtornos psiquiátricos, como depressão e ansiedade, foi amplamente aceita pela comunidade médica. No entanto, a relação entre serotonina, depressão e ansiedade não está ainda completamente esclarecida, embora seja inegável que o uso de inibidores seletivos de recaptação de serotonina foi um grande avanço no tratamento desses transtornos. A descoberta de que a serotonina está diretamente envolvida em modificações epigenéticas que resultam em mudanças na utilização do DNA pelas nossas células pode ser a peça que faltava para esse enigma.
A participação da serotonina em mecanismos de herança epigenética não é um fato novo. Já sabemos, por exemplo, que a serotonina é capaz de ativar cascatas de sinalização, mediante ativação do receptor de serotonina, que resultam na remodelação da cromatina, um dos principais mecanismos de herança epigenética (Figura 2a). Serotonilação de proteínas também não é, por si só, um fenômeno novo. Já sabíamos que a serotonina é capaz de se ligar a outras proteínas celulares, alterando o seu funcionamento. Mas essa é a primeira vez que temos evidência de que a serotonina se liga diretamente a histonas, modificando a interação dessas proteínas com o DNA e influenciando os padrões de expressão gênica (Figura 2b). Essa interação ocorre mediante o trânsito de serotonina para o núcleo celular, onde se liga diretamente a histonas (seta, Figura 2b).
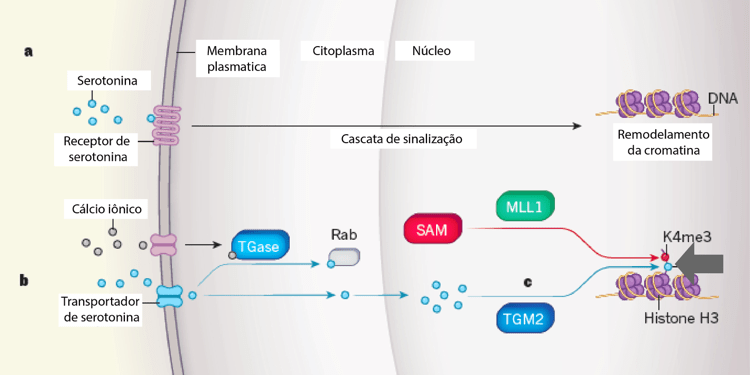
Sem dúvida, ainda temos muito o que aprender a respeito dos mecanismos de herança epigenética e as implicações dessa herança para os processos de saúde e doença. A descoberta da serotonilação de histonas é apenas um exemplo do quanto ainda temos a pesquisar, e quão pouco ainda sabemos sobre a relação entre o nosso comportamento, nossas emoções e modificações epigenéticas.
Como nossas dietas e modos de vida influenciam essa forma de “marcar” o DNA? Como o nosso humor pode influenciar essas “marcações” e como isso pode influenciar o comportamento dos nossos filhos? Qual o papel da serotonilação de histonas nas doenças psiquiátricas? Teremos, agora, uma nova via de tratamento desses transtornos? Que outros efeitos a serotonilação de histonas possui no nosso metabolismo? Enquanto não temos respostas a todas essas perguntas, sejamos prudentes: tenhamos menos medo e sejamos mais felizes. Talvez assim possamos influenciar positivamente (e epigeneticamente) as futuras gerações!
Ana Almeida
(California State University East Bay)
Para saber mais:
Carhart-Harris RL, Nutt DJ. 2017. Serotonin and brain function: a tale of two receptors. J. of Phychopharmacology, 31(9): 1091-1120.
Lacal I, Ventura R. 2018. Epigenetic Inheritance: Concepts, Mechanisms, and Perspectives. Frontiers in Molecular Neuroscience, doi: 10.3389/fnmol.2018.00292.
Lind MI, Spagopoulou F. 2018. Evolutionary consequences of epigenetic inheritance. Heredity, 121: 205-209.
Romanowska J, Joshi A. 2019. From Genotype to Phenotype: Through Chromatin. Genes, 10(2): 76.
Imagem de abertura: AndreaAP96. Wikipedia, CC-BY-SA-4.0.



